

"A carne processada contém quatro vezes mais sódio e conservantes a base de nitrato. Isso sugere que sal e conservantes, mais do que gorduras, aumentem o risco de ataque cardíaco e diabetes", diz a líder da pesquisa, Renata Micha.
O sal é conhecido por aumentar a pressão sanguínea, o que pode aumentar o risco de problemas cardíacos. Alguns dos estudos analisados sugerem que conservantes de nitrato aumentam depósitos nas artérias, o que dificulta a capacidade do corpo de processar açúcares, e por consequência, aumenta ainda mais as chances de problemas de coração e diabetes. Para quem não consegue viver sem bacon, salame, salsicha, presunto e outros, a pesquisa diz "comendo uma porção semanal ou menos pode estar associado a um risco relativo menor".
Referência:http://revistagalileu.globo.com/Revista/Common/0,,EMI140942-17770,00-CONSUMIR+EMBUTIDOS+AUMENTA+O+RISCO+CARDIACO+EM+DIZ+ESTUDO+DE+HARVARD.html

É denominado tumor qualquer tipo de crescimento anormal, seja ele canceroso (maligno) ou não canceroso (benigno). Os tumores originários do coração são denominados tumores primários e podem ocorrer em qualquer um de seus tecidos. Eles podem ser cancerosos ou não cancerosos e são raros. Os tumores secundários originam- se em alguma outra parte do corpo – geralmente no pulmão, na mama, no sangue ou na pele – e, em seguida, disseminam-se (produzem metástases) ao coração.
Eles sempre são cancerosos. Os tumores secundários são trinta a quarenta vezes mais comuns que os primários, mas, ainda assim, são considerados incomuns. Os tumores cardíacos podem não provocar sintomas ou podem produzir uma disfunção cardíaca potencialmente letal, simulando outras cardiopatias. Exemplos de tais disfunções incluem a insuficiência cardíaca súbita, o surgimento abrupto de arritmias e uma queda súbita da pressão arterial decorrente do sangramento no pericárdio (a membrana que envolve o coração).
Os tumores cardíacos são de difícil diagnóstico, tanto por serem relativamente incomuns, quanto pelo fato de seus sintomas serem semelhantes aos de de muitos outros distúrbios. Para chegar ao diagnóstico, é necessário que o médico tenha indícios de sua presença. Por exemplo, se um indivíduo apresenta um câncer em qualquer outra região do corpo, mas procura auxílio médico por causa de sintomas relacionados à disfunção cardíaca, o profissional pode suspeitar da presença de um tumor cardíaco.
Referência:http://mmspf.msdonline.com.br/pacientes/manual_merck/secao_03/cap_020.html

As Neoplasias cardíacas são tumores benignos ou malignos decorrentes principalmente no forro interior, na camada muscular, ou no pericárdio em torno do coração.
Estas neoplasias ou tumores cardíacos podem ser primários ou metastásicos.
Tumores cardíacos primários são raros na prática pediátrica, com uma prevalência de 1.7/1000 para 28/1000 em séries de necropsia.
Em contraste, a incidência de tumores cardíacos durante a vida fetal tem sido relatada em aproximadamente 1.4/1000.
A incidência de metástases cardíacas associadas com todos os tipos de tumores malignos é estimada em aproximadamente em 1% de todos os nascidos (e é 10-20 vezes maior do que tumores malignos primários do coração).
A grande maioria dos tumores cardíacos primários em crianças são benignos, enquanto aproximadamente 10% são malignos.
Em contraste, a maioria dos tumores secundários são malignos.
Em adultos, porém, a freqüência e o tipo de tumores cardíacos em adultos diferem daqueles em crianças com 75% sendo benignos e 25% são malignos.
Os mixomas são os tumores primários mais comuns em adultos, constituindo 40% dos tumores benignos.
Sarcomas compõem 75% dos tumores malignos nas massas cardíacas.
O Rabdomioma é o tumor cardíaco mais comum durante a vida fetal e infância. É responsável por mais de 60% de todos os tumores cardíacos primários.
As manifestações de um tumor cardíaco na vida fetal incluem arritmias, insuficiência cardíaca congestiva, hidropisia, e não raro natimorto.
Na vida pós-natal tumores cardíacos podem levar a cianose, sopro, problemas respiratórios, disfunção do miocárdio, insuficiência valvular, arritmias e morte súbita.
Os exames de Ecocardiografia, Informática Tomografia (CT) e Ressonância Magnética (RM) do coração são os principais instrumentos de diagnóstico invasivo.
O Cateterismo cardíaco raramente é necessário.
O resultado doTumor com a avaliação histológica da biópsia continua sendo a chave-de-ouro para confirmação do diagnóstico.
A ressecção cirúrgica dos tumores cardíacos primários devem ser considerados para aliviar os sintomas e obstrução mecânica ao fluxo sangüíneo.
O resultado de ressecção cirúrgica em sintomáticos, nos casos de tumores cardíacos benignos não-mixomatosos são favoráveis.
Pacientes com tumores primários cardíacos poderão beneficiar da cirurgia paliativa, mas esta abordagem não deve ser recomendada para pacientes com metástase de tumores cardíacos. A Cirurgia, quimioterapia e radioterapia podem prolongar a sobrevivência.
O prognóstico para os tumores cardíacos malignos primários são geralmente muito pobres.
Referência: http://saude.psicologiananet.com.br/tumores-cardiacos-em-criancas-neoplasias-do-coracao-em-criancas.html

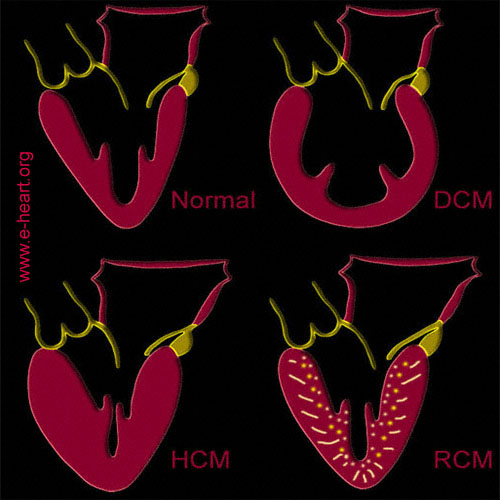


 alva Mitral
alva Mitral
Angina do Peito
A angina do peito apresenta-se sob duas formas, a estável e a instável.
Tanto a instável como a estável têm manifestações ou sintomas semelhantes aos do infarto do miocárdio. Elas podem evoluir para um infarto do miocárdio quando não tratadas.
A angina do peito estável se diferencia do infarto por algumas das características abaixo:
Os sintomas da angina de peito estável variam de pessoa para pessoa, mas, num mesmo indivíduo, costumam ser semelhantes, e num mesmo indivíduo costumam ter os seus fatores desencadeantes bem conhecidos, como fazer força, caminhar no vento frio, subir escadas, atividade sexual, e outras.
Os sintomas da angina de peito instável costumam surgir em repouso ao levantar pela manhã, e são de aparecimento súbito, com dores e desconforto moderado a severo, evoluem rapidamente para um estágio em que há um aumento no desconforto e na dor, tanto na intensidade como severidade.
Algums sinais:
-Pressão e desconforto, dor em aperto no centro do peito que dura mais do que alguns minutos ou que vai e volta.
-Dor do centro do peito que irradia para os ombros, queixo, pescoço e braços, mais freqüentemente para o braço esquerdo.
-Desconforto no peito com sensação de cabeça leve, sensação de desmaio, suores e falta de ar.
Nos homens a dor pré-cordial é o sintoma mais freqüente, já nas mulheres o cansaço e fadiga extrema são os sintomas mais encontrados.
Nas mulheres é mais freqüente sentir náuseas, dores no epigástrio, ou nas costas, pescoço ou queixo.
Muitas vezes, sintomas outros que não a dor, são sentidos já há muito tempo antes do infarto ocorrer.
A intensidade da dor do infarto varia muito de doente para doente. A dor não necessita ser intensa.
A dor geralmente irradia para o braço esquerdo, mas em 15% dos atingidos irradia para o braço direito.
Muitos sintomas de doença das coronárias são ignorados pelos pacientes e também pelos médicos. Existem infartos silenciosos, que são revelados ao eletrocardiograma ou outros exames por ocasião de exames rotineiros.
Exija do seu médico que investigue a causa de seus sintomas, principalmente se pertencer a um grupo de risco.
A parte do coração que necrosar, morrer, por ocasião de um infarto não é mais viável e não produzirá sintomas como dor. Logo, enquanto o doente sentir dor resta tecido cardíaco viável que pode se recuperar por si ou com tratamentos adequados. Quanto antes esse tecido doente for tratado, maiores as chances de ser recuperado.
Se isso acontecer, se notar uma ou mais de uma das manifestações acima, não espere, vá ou chame imediatamente um serviço de emergência.
Postado por: Diêgo, Anthony, Davi. Biomedicina 221-5
Referências: www.drauziovarella.com.br
O infarto do miocárdio se dá quando o suprimento de sangue a uma parte do músculo cardíaco é reduzido ou cortado totalmente. Isso acontece quando uma artéria coronária está contraída ou obstruída, parcial ou totalmente.
Com a supressão total ou parcial da oferta de sangue ao músculo cardíaco, ele sofre uma injúria irreversível e, parando de funcionar, o que pode levar à morte súbita, morte tardia ou insuficiência cardíaca com conseqüências desde severas limitações da atividade física até a completa recuperação.O ATAQUE DO CORAÇÃO 
Sinônimos e Nomes Populares
O termo dos médicos para ataque do coração é Infarto do Miocárdio. Enfarte do miocárdio, doença isquêmica do coração, obstrução das coronárias, crise cardíaca. No nosso meio, o termo mais usado é infarto.
O que é?
O infarto do miocárdio se dá quando o suprimento de sangue a uma parte do músculo cardíaco é reduzido ou cortado totalmente. Isso acontece quando uma artéria coronária está contraída ou obstruída, parcial ou totalmente.
Com a supressão total ou parcial da oferta de sangue ao músculo cardíaco, ele sofre uma injúria irreversível e, parando de funcionar, o que pode levar à morte súbita, morte tardia ou insuficiência cardíaca com conseqüências desde severas limitações da atividade física até a completa recuperação.
O infarto do miocárdio é a causa mais freqüente de morte nos Estados Unidos. O infarto do miocárdio pode também acontecer em pessoas que têm as artérias coronárias normais. Isso acontece quando as coronárias apresentam um espasmo, contraindo-se violentamente e também produzindo um déficit parcial ou total de oferecimento de sangue ao músculo cardíaco irrigado pelo vaso contraído.
Esse tipo de espasmo também pode acontecer em vasos já comprometidos pela ateroesclerose.
É a morte inesperada provocada por diferentes formas de cardiopatia, no período de 1 a 24 horas após o início dos sintomas agudos (alguns autores defendem um período de até 1 hora).
Aproximadamente 80% das vítimas apresentam quadro de arteriosclerose estenosante (estreitamento do vaso sanguíneo provocada por depósitos de gordura na parede do mesmo).
Algums fatores de risco que pode favorecer a doença podemos citar o tabagismo, o álcool, a hipertensão, a diabetes, etc...
1) uma pressão desconfortável no peito ou nas costas que demora mais do que alguns minutos para ir embora
2) a dor espalha-se para os ombros, pescoço ou braços.
3) A dor no peito vem acompanhado de tonturas, suor, náusea, respiração curta ou falta de ar e sensação de plenitude gástrica.
Nem todos estes sintomas ocorrem em cada ataque. Algumas vezes podem ir e voltar. Peça auxílio urgente sempre que isto ocorrer.
Postado por: Diêgo, Anthony, Davi. Biomedicina 221-5
Referências: WWW.cardiol.com.br

FATORES DE RISCO
PREVENÇÃO
A Insuficiência Cardíaca Congestiva (ICC) representa o conjunto de sinais e sintomas decorrentes do mal funcionamento do coração, quando este não está sendo capaz de bombear o sangue em direção aos tecidos e suprir a necessidade de oxigênio e nutrientes do organismo.
O processo que resulta na ICC é gradativo e os eventos têm a seguinte seqüência:
1. O bombeamento insuficiente do coração leva a uma congestão de sangue no interior das veias que chegam ao coração,
2. O acúmulo de sangue nas veias, associado à retenção de líquidos pelos rins, levam ao inchaço (edema) dos tecidos do corpo.
3. O inchaço inicialmente afeta as pernas, mas pode subir e também atingir os pulmões (causando dificuldades para respirar) e em outros tecidos e órgãos (levando à “barriga d’água, dores abdominais, pouca urina, etc).
4. O cansaço leva à falta de ar, à fraqueza muscular, à diminuição da atividade física e conseqüente invalidez.
Só o envelhecimento da população (aumento da longevidade) já é fator de aumento da incidência da ICC, pois, naqueles com mais de 75 anos, é observada em mais de 10% dos pacientes, sendo diagnosticada em menos de 2% naqueles com menos de 55 anos de idade. Isto, associados aos avanços médicos que prolongaram a vida dos pacientes com outras formas de doença do coração, permitiu que a ICC crescesse em incidência.
A insuficiência cardíaca congestiva é freqüentemente a fase final de outra doença do coração como:
1. Doença Coronariana (levando à angina e ao Infarto agudo do coração);
2. Hipertensão arterial (que pode se complicar com os derrames cerebrais);
3. Doença Valvular do Coração (incluindo a doença reumática do coração);
4. Síndromes Congênitas ("de nascença") do Coração;
5. Miocardiopatias (doença do músculo do coração);
6. Infarto Agudo do Miocárdio (ataque cardíaco);
7. Arritmias Cardíacas (problemas onde o coração bate sem controle – mais rápido, mais devagar ou sem ritmo),
8. Exposições Tóxicas, incluindo o uso abusivo de álcool.
9. Hipertireoidismo, Diabetes e Doença Pulmonar Obstrutiva Crônica (Bronquite) também são fatores de risco para a ICC. Todas estas desordens podem conduzir à insuficiência cardíaca congestiva debilitando o músculo do coração.
Quadro Clínico
O primeiro sintoma da insuficiência cardíaca congestiva pode ser simplesmente o cansaço. Como o avanço da doença, pode haver dificuldades para respirar durante os esforços, e eventualmente um “encurtamento” da respiração durante o repouso, podendo tornar-se ofegante. Como os fluidos acumulam nos pulmões, os pacientes com insuficiência cardíaca podem começar a dormir amparado por travesseiros mais altos para tornar a respiração mais fácil. Os líquidos também podem se acumular nas pernas e tornozelos, levando ao edema (inchaço). Em pacientes menos ativos, os líquidos podem acumular na metade inferior do corpo, eventualmente causando edema da parte mais baixa das costas. Pode ocorrer inchaço dos intestinos que produz desconforto abdominal. Em alguns pacientes, pode haver uma necessidade de urinar várias vezes durante a noite, como os rins eliminam os excessos de fluidos do organismo que acumularam no corpo durante o dia. Como o corpo acumula cada vez mais fluidos, o paciente pode notar significativo ganho de peso. Também pode haver uma tosse crônica devido ao acúmulo de fluidos nos pulmões.
Embora a insuficiência cardíaca congestiva normalmente afeta ambos os lados do coração, em alguns pacientes pode afetar só a parte esquerda ou direita. Nestes casos, os sintomas variam de acordo com o lado afetado. Por exemplo, quando a insuficiência cardíaca afetar principalmente o lado esquerdo do coração, os sintomas mais prováveis irão envolver dificuldades para respirar. Quando o lado direito é o principal afetado, o inchaço das pernas e o desconforto abdominal podem ser os sintomas mais proeminentes.
Seu médico revisará sua história clínica enfatizando a presença de fatores de risco para a insuficiência cardíaca congestiva, especialmente uma história de doença coronária do coração, hipertensão, doença das válvulas cardíacas, arritmias, doenças congênitas do coração, cardiomiopatias, e enfarto do miocárdio. Seu médico também perguntará sobre detalhes específicos de seus sintomas, incluindo: quantos quarteirões você pode caminhar sem ter falta de ar, o número de travesseiros que você dorme e com que freqüência você acorda à noite para urinar.
Seu médico suspeitará que você tem insuficiência cardíaca congestiva baseado em seus sintomas e em sua história clínica. Evidência adicional para apoiar este diagnóstico virá de seu exame físico e dos testes adicionais. Durante seu exame físico, o médico conferirá seus sinais vitais, determinará sua freqüência e ritmo cardíacos e escutará os sons anormais do coração com um estetoscópio. Ele também escutará seus pulmões para verificar os sons anormais da respiração quando o acúmulo de fluidos é perceptível. Seu médico apertará na pele de suas pernas e tornozelos para conferir o inchaço, ele também pode examinar seu abdômen para conferir o tamanho de seu fígado (o acúmulo de líquidos do coração pode causar inchaço do fígado).
Portadores de doença arterial coronariana e disfunção ventricular esquerda grave podem se beneficiar da cirurgia de revascularização do miocárdio. Muito se tem debatido quanto à apropriada seleção dos pacientes que devem ser submetidos ao procedimento. Nosso estudo mostrou, que a análise individual de três variáveis histopatológicas, adquiridas por biópsias endomiocárdicas no transoperatório e no pós operatório tardio de revascularização do miocárdio, em pacientes com disfunção ventricular grave, foi insuficiente para predizer quem se beneficiaria com incremento na fração de ejeção ventricular esquerda após o procedimento. Contudo, a combinação de alterações histológicas, indicando menor grau de remodelamento, associou-se a uma melhora na função ventricular no período pós-operatório.
Nossa população é uma típica coorte de pacientes com cardiomiopatia avançada, caracterizada por disfunção ventricular esquerda grave e importante limitação funcional por insuficiência cardíaca congestiva. Para esses pacientes, apesar do desenvolvimento da terapia medicamentosa, o prognóstico continua sombrio6,7. Assim, a cirurgia de revascularização tem ganho destaque como importante opção terapêutica, devido ao progresso de técnicas operatórias e de proteção miocárdica14. Luciani e cols estudaram 143 pacientes com fração de ejeção <>15. No presente estudo, a mortalidade perioperatória, até 30 dias da cirurgia, foi de 8.3% (dois pacientes).
POSTADO POR: Maria Albertina Deodato de Brito,em 21 de março de 2010 às 21:30hs
REFERÊNCIA:http://www.scielo.com/scielo.php?pid